Der "Nestler Chemiker Nr. 33"
Anders als die organisch-chemische Analyse, die auf ein paar Elemente beschränkt ist (fast ausschließlich Kohlenstoff C, Wasserstoff H und Sauerstoff O), beschäftigt sich die anorganisch-chemische Analyse mit den restlichen etwa 100 Elementen. Deren quantitative Bestimmung in Mineralien, Umweltproben, u. s. w., kann sehr anspruchsvoll sein.
Der Nestler Chemie Nr. 33 war auf die quantitative anorganische Analytik optimiert — anders als der Faber-Castell. Er wurde wohl um 1925 hergestellt, wie man am Atomgewicht für Stickstoff (N) von 14,008 und dem für Kohlenstoff (C) von 12,00 auf der Rückseite des Körpers durch Vergleich mit der historischen Entwicklung der Atomgewichte schließen kann.
Die chemischen Markierungen
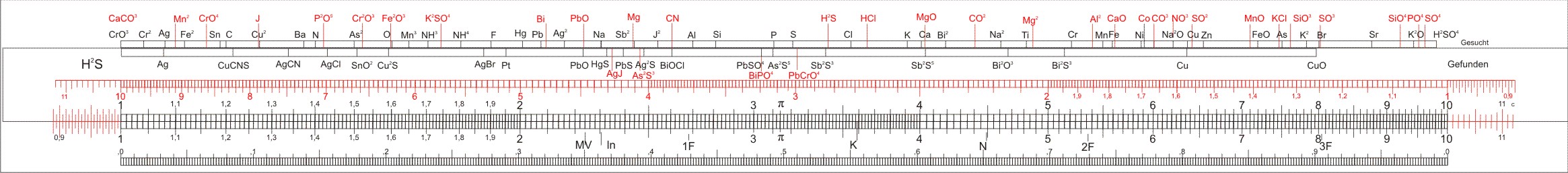
Der obere Teil des Körpers trägt Markierungen mit chemischen Symbolen (der Übersicht halber sind einige rot). Bezogen auf logarithmische Skala im unteren Teil stellen die Markierungen das Molekulargewicht dar (bzw. dessen Logarithmus).
| CaCO3 | CrO3 | Cr2 | Ag | Mn2 | Fe2 | CrO4 | Sn | C | Cu2 |
| J | Ba | N | P2O5 | As2 | Cr2O3 | O | Fe2O3 | Mn3 | NH3 |
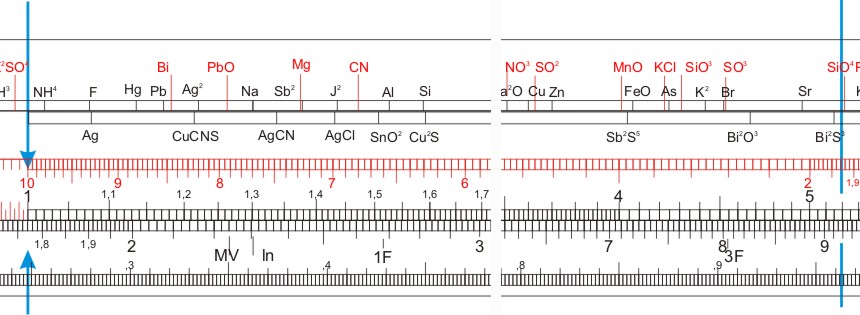
| KSO4 | NH4 | F | Hg | Pb | Bi | Ag2 | PbO | Na | Sb2 |
| Mg | J2 | CN | Al | Si | P | S | H2S | Cl | HCl |
| K | Ca | MgO | Bi2 | CO2 | Na2 | Ti | Mg2 | Cr | Al2 |
| Mn | Fe | CaO | Ni | Co | CO3 | Na2O | NO3 | Cu | SO2 |
| Zn | MnO | FeO | KCl | As | SiO3 | K2 | SO3 | Br | Sr |
| SiO4 | K2O | PO4 | SO4 | H2SO4 | |||||
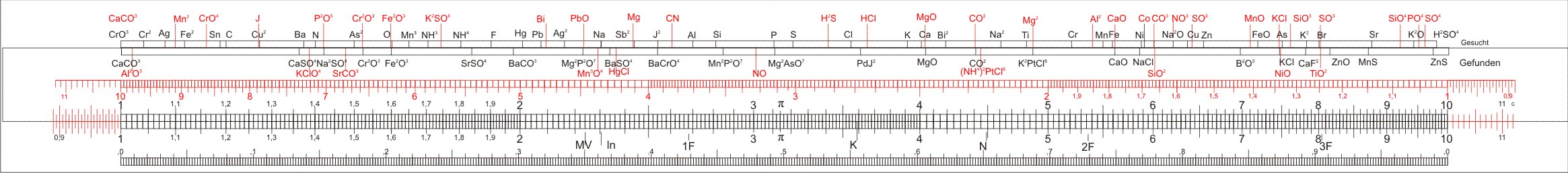
Die Zunge hat ähnliche Markierungen, allerdings unterschiedliche auf Vorder- und Rückseite.
| CaCO3 | Al2O3 | CaSO4 | KClO4 | Na2SO4 | SrCO3 | Cr2O3 | Fe2O3 | SrSO4 | BaCO3 |
| Mg2P2O7 | Mn3O4 | HgCl | BaSO4 | BaCrO4 | Mn2P2O7 | NO | Mg2As2O7 | CO2 | (NH4)2PtCl6 |
| K2PtCl6 | CaO | NaCl | SiO2 | B2O3 | KCl | NiO | CaF2 | TiO2 | ZnO |
| MnS | ZnS | ||||||||
| Ag | CuCNS | AgCN | AgCl | SnO2 | Cu2S | AgBr | Pt | PbO | HgS |
| AgJ | PbS | As2S3 | Ag2S | BiOCl | Sb2S3 | Bi2O3 | Cu | CuO | |
Diese Skalen mit Atomgruppen und Verbindungen gehen auf William Hyde Wollastons Synoptic Scale of Equivalents zurück. Sie bilden im Grunde das Gesetz der konstanten Proportionen (1797 von Joseph-Louis Proust aufgestellt) ab, wonach die Elemente in einer stabilen chemischen Verbindung immer im gleichen Verhältnis vorkommen.
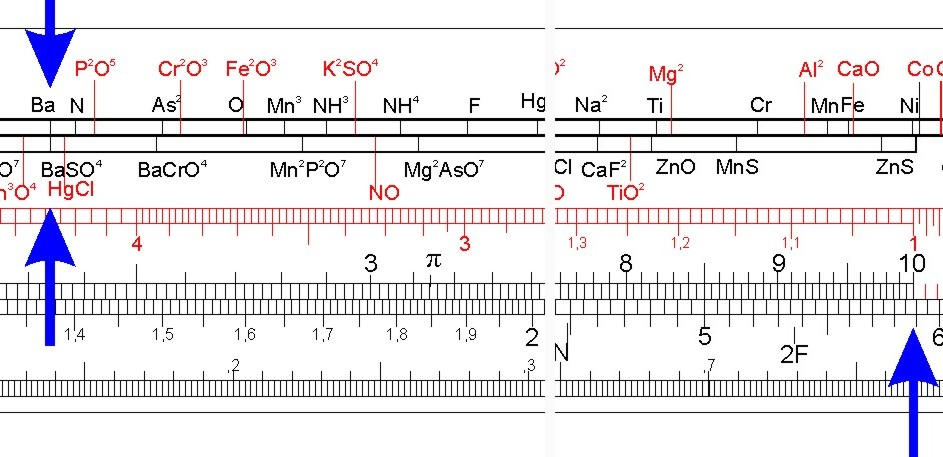
Die Verbindung Bariumsulfat (BaSO4) besteht also aus Barium (Ba) und dem Sulfatanion (SO4-2) im Verhältnis 1 : 1. Da Chemiker gerne und sehr genau wägen, interessiert sie das Gewichtsverhältnis der Bestandteile:
- MGBa = 137,3 g,
- MGSO4 = MGS + 4 · MGO = 32 g + 64 g = 96 g,
- also:
- MGBaSO4 = 137 g + 96 g = 233 g.
- 100 g Bariumsulfat enthalten damit:
- (137 g ⁄ 233) · 100 = 58,8 % Barium und
- (96 g ⁄ 233) g · 100 = 41,2 % Sulfationen.
Dieses Verhältnis ist für jede Menge Bariumsulfat konstant.
Man findet es mit dem Nestler Chemiker 33:
Zur Lösung stellt unter das Symbol auf der Körperskala (Gesucht) die Verbindung auf der Zungenskala (Gefunden) und liest unter "1" oder "10" der Zunge auf der unteren Körperskala das Ergebnis ab: Ba = 0,588 und SO4-2 = 0,412. Nun kann man durch Verschieben des Läufers diesen "Äquivalenz-Faktor" mit dem Probengewicht multiplizieren, und erhält den Gewichtsanteil des jeweiligen Bestandteils an der Probenmenge.
Weitere Markierungen
Auf dem unteren Teil des Körpers sind noch die Markierungen MV, ln, 1F, K, N, 2F und 3F angebracht. Sie dienen zur Vereinfachung spezieller Analysemethoden.
- MV = 22,4. Molvolumen der Gase.
- ln = 2,27. Eulersche Zahl.
- 1F = 26,8 A · h. Zur Bestimmung der Menge a elekrolytisch abgeschiedener Elemente
- a = (Atomgewicht ⁄ nF) · Strommenge.
- K = 273 ⁄ 760 = 0,3592. Reduktionskonstante für Gasvolumina auf Normalbedingungen.
- N = 273 ⁄ 760 · 0,0012505 =0,004491. K · ρN, zur direkten Bestimmung des Gewichts eines aufgefangenen Stickstoffvolumens.
- 2F, 3F: Vielfache von 1F, zur elektrolytischen Bestimmung mehrwertiger Metalle.
Bestimmung von Chlorid
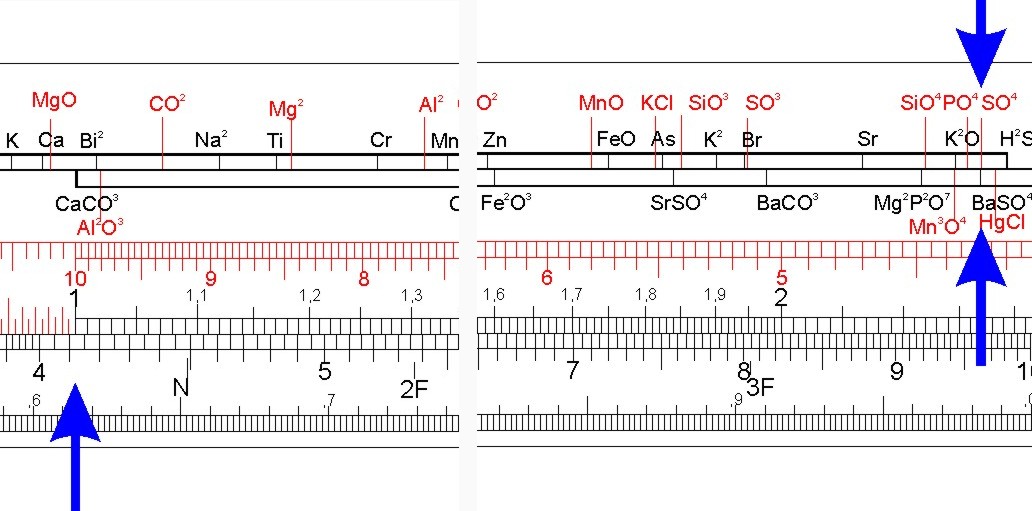
Das Beispiel einer quantitativen Bestimmung von Chlorid soll ein Schritt eines Analyseablaufs sein.
Bei einer Chloridbestimmung betrug die Einwaage s = 0,520 g, erhalten wurde als Niederschlag a = 0,370 g AgCl. Gesucht: g und % Cl in der Substanzeinwaage s.
- g Cl = (Cl ⁄ AgCl) · a
- % Cl = (Cl ⁄ AgCl) · (a ⁄ s) · 100
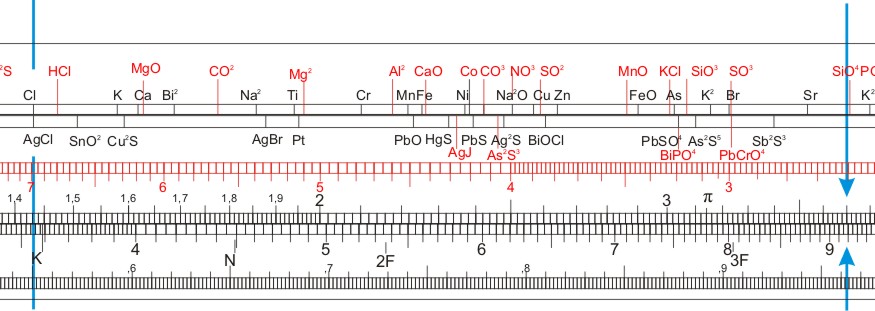
Die Lösung findet man mit der AgCl-Marke der Zunge unter der Cl-Marke auf dem Körper durch verschieben des Läufers auf 0,370 auf der Zunge. Nun liest man auf dem Körper ab: g Cl = 0,0916 g.
Verschiebt man nun die Zunge, sodass s = 0,520 g unter dem Läuferstrich steht, liest unter der 1 auf der Zunge ab: % Cl = 17,6 %.
Biographische Notizen
- William Hyde Wollaston
- englischer Physiker und Chemiker. * 6. Aug. 1766, † 22, Dez. 1828. Entdeckte u. a. die Elemente Palladium (1802) und Rhodium (1804). War Anhänger der Atomtheorie John Daltons, und Gegner der Äquivalenttheorie von Humphry Davy. Entwickelte 1814 die "Synoptic Scale of Equivalents".
- Joseph Louis Proust
- französischer Chemiker. * 26. Sep. 1754, † 5. Jul. 1826. Einer der führenden Analytiker, entwickelte die Schwefelwasserstofffällung, formulierte 1794 das Gesetz der konstanten Proportionen, das die Atomtheorie begründete.
Quellen
- Walter Wittenberger: Rechnen in der Chemie. Grundoperationen — Stöchiometrie. Wien 1961.
- Michael Faraday: Chemical Manipulation: Being Instructions to Students in Chemistry. London 1842.
Themen
[Einleitung]
[Faber-Castell]
[Nestler 33]
[chemisches Rechnen]
[Periodensystem]
[Vorproben]
[Quantitative Analyse]
[Stöchiometrische Tafel]